ĐAU TRONG UNG THƯ DI CĂN XƯƠNG
GS. TS. Mai Trọng Khoa, BSNT. Nguyễn Hoàng Việt, PGS. TS. Phạm Cẩm Phương, PGS. TS. Phạm Văn Thái
Trung tâm Y học hạt nhân và Ung bướu, Bệnh viện Bạch Mai
I. TỔNG QUAN VÀ DỊCH TỄ VỀ DI CĂN XƯƠNG.
Hệ xương là vị trí phổ biến thứ ba cho di căn ung thư, chỉ sau phổi và gan. Nhiều bệnh lý ung bướu như ung thư vú, tuyến tiền liệt, phổi và thận, có khuynh hướng di căn mạnh mẽ đến xương, gây đau, tăng canxi máu, gãy xương bệnh lý, chèn ép tủy sống hoặc các cấu trúc thần kinh khác, giảm khả năng vận động và tăng tỷ lệ tử vong. Đau xương do ung thư di căn (CIBP) là một loại đau mãn tính với sinh lý bệnh phức tạp được đặc trưng bởi các yếu tố kích thích cảm giác đau và các receptor tương ứng trên xương.
Ung thư vú, phổi và tuyến tiền liệt là nguyên nhân chung gây ra 80% di căn ung thư đến xương. Có tới 65%tổng số di căn xương bắt nguồn từ ung thư vú ở phụ nữ và ung thư tuyến tiền liệt ở nam giới. 35% trường hợp di căn còn lại phát sinh từ ung thư thận, tuyến giáp và phổi. Tỷ lệ di căn xương tương đối là 65–75% trong ung thư vú, 65–75% trong ung thư tuyến tiền liệt, 60% trong ung thư tuyến giáp, 40% trong ung thư bàng quang, 20–25% ung thư biểu mô tế bào thận và 14–45% trong ung thư hắc tố. Di căn ung thư đến hệ xương thường nằm ở đốt sống (69%), tiếp theo là xương chậu(41%), xương dài (thường là xương đùi gần) (25%) và hộp sọ (14%). Chúng ít xảy ra thường xuyên ở xương sườn, xương ức và xương cánh tay gần [10]. Thông thường, sự di căn diễn ra qua máu; Nó xảy ra ít thường xuyên hơn thông qua sự xâm nhập từ các mô xung quanh hoặc qua hệ thống bạch huyết hoặc dịch não tủy (con đường sau ảnh hưởng đến trẻ em thường xuyên hơn).
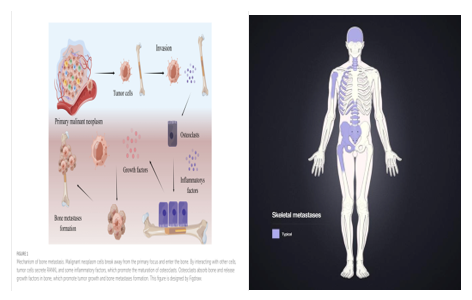
Hình 1. Cơ chế di căn xương theo đường máu và các vị trí thường gặp.
Tổn thương di căn xương có thể biểu hiện dưới ba hình thái chính: tạo xương, hủy xương hoặc hỗn hợp.
– Tổn thương dạng tạo xương là hậu quả của sự gia tăng hoạt động chuyển hóa xương khu trú do đáp ứng của mô xương với tổ chức di căn, chủ yếu thông qua sự tăng sinh và hoạt hóa của tạo cốt bào. Trên hình ảnh học, tổn thương biểu hiện bằng vùng tăng đậm độ xương; trên xạ hình xương ghi nhận sự tăng bắt xạ rõ rệt tương ứng với vùng tăng chuyển hóa xương.
– Tổn thương dạng hủy xương là kết quả của quá trình phá hủy xương khu trú do sự hoạt hóa quá mức của hủy cốt bào dưới tác động của tế bào ung thư. Trên chẩn đoán hình ảnh, tổn thương biểu hiện bằng vùng giảm đậm độ xương, tiêu xương, làm suy yếu cấu trúc xương và làm tăng nguy cơ gãy xương bệnh lý.
– Tổn thương dạng hỗn hợp là tình trạng đồng thời tồn tại cả hai quá trình hủy xương và tạo xương trong cùng một ổ di căn, phản ánh sự rối loạn cân bằng giữa hoạt động của hủy cốt bào và tạo cốt bào. Trên hình ảnh học, tổn thương biểu hiện xen kẽ vùng tiêu xương và vùng đặc xương, còn trên xạ hình xương thường thấy tăng bắt xạ không đồng nhất.
Di căn xương gây ra nhiều biến chứng lâm sàng nghiêm trọng, ảnh hưởng trực tiếp đến chất lượng sống, khả năng vận động và tiên lượng của người bệnh. Các biến chứng thường gặp bao gồm đau xương, gãy xương bệnh lý, chèn ép tủy sống, tăng calci máu và suy giảm chức năng vận động.
– Đau xương là triệu chứng thường gặp nhất và thường là biểu hiện sớm của di căn xương. Đau xuất hiện do sự kích thích màng xương, tăng áp lực nội xương và phá hủy cấu trúc xương.Đau có tính chất âm ỉ, tăng dần theo thời gian, thường tăng về đêm và đáp ứng kém với thuốc giảm đau thông thường.
– Gãy xương bệnh lý xảy ra khi cấu trúc xương bị phá hủy nghiêm trọng tại vị trí di căn, chỉ cần sang chấn nhẹ cũng có thể gây gãy. Các vị trí hay gặp bao gồm cột sống, xương đùi, xương chậu và xương cánh tay. Gãy xương bệnh lý làm mất chức năng vận động, gây đau dữ dội và làm tăng tỷ lệ tàn phế.
– Chèn ép tủy sống là biến chứng nặng, thường gặp khi di căn xâm lấn thân đốt sống gây xẹp đốt sống hoặc khối u phát triển vào ống sống. Lâm sàng biểu hiện đau cột sống dữ dội, yếu liệt tiến triển, rối loạn cảm giác và rối loạn cơ tròn. Đây là tình trạng cấp cứu ung thư cần được can thiệp kịp thời để tránh tổn thương thần kinh không hồi phục.
– Tăng calci máu là hậu quả của quá trình hủy xương mạnh do hoạt động của hủy cốt bào, thường gặp trong di căn dạng hủy xương lan rộng. Biểu hiện lâm sàng bao gồm mệt mỏi, chán ăn, buồn nôn, táo bón, rối loạn ý thức, rối loạn nhịp tim và có thể dẫn đến hôn mê nếu không được xử trí kịp thời.
– Suy giảm chức năng vận động và chất lượng sống là hệ quả chung của đau kéo dài, gãy xương, chèn ép thần kinh và suy kiệt toàn thân. Người bệnh giảm khả năng đi lại, tự chăm sóc, phụ thuộc vào người khác và có nguy cơ cao biến chứng nằm lâu như viêm phổi, loét tỳ đè và huyết khối tĩnh mạch sâu.
II. DỊCH TỄ VÀ SINH LÝ BỆNH CỦA ĐAU XƯƠNG DO DI UNG THƯ DI CĂN.
Đau xương là một trong những loại đau phổ biến nhất ở bệnh nhân ung thư. Khoảng 60–84% bệnh nhân ung thư giai đoạn cuối được ước tính trải qua các mức độ đau xương khác nhau. Tình trạng này ảnh hưởng đến hàng triệu bệnh nhân trên toàn thế giới cũng như Việt Nam. Điều thú vị là tỷ lệ mắc và mức độ nghiêm trọng của đau xương không phải lúc nào cũng tỷ lệ thuận với số lượng và kích thước di căn xương. Khoảng 25% bệnh nhân có di căn như vậy không cảm thấy đau. Một số tổn thương gây phàn nàn nhẹ, trong khi những tổn thương khác, mặc dù đơn lẻ hoặc kích thước nhỏ, gây đau rất dữ dội khi không có gãy xương bệnh lý. Sự đa dạng của các triệu chứng này là kết quả của những đóng góp khác nhau của các cơ chế trung tâm và ngoại vi và các khả năng khác nhau để giảm hoạt động ngoại vi của các hệ thống điều chế trung tâm, cho thấy sự khác biệt đáng kể của từng cá nhân. Cơ chế đau mà bệnh nhân gặp phải do di căn đến xương rất phức tạp. Nó liên quan đến các tương tác khác nhau giữa các tế bào khối u, tế bào xương, tế bào viêm được kích hoạt và các tế bào thần kinh nội xương. Nó bao gồm các quá trình viêm và bệnh thần kinh, được điều chỉnh ở cấp độ các mô ngoại vi và dây thần kinh, cũng như ở cấp độ cao hơn của hệ thần kinh (tủy sống và não).
Giai đoạn đầu tiên của di căn xương liên quan đến việc tách các tế bào ung thư khỏi khối u nguyên phát và sự xâm nhập của chúng vào tuần hoàn toàn thân. Các tế bào khối u trải qua quá trình chuyển đổi biểu mô – trung mô (EMT). Đó là, kiểu hình của chúng thay đổi từ biểu mô sang trung mô do mất protein kết dính giữa các tế bào trên bề mặt tế bào. Một phần quan trọng của quá trình này được đóng bởi ma trận metalloproteinase (MMP) được sản xuất bởi các tế bào khối u. MMP góp phần vào sự suy thoái của ma trận ngoại bào, và do đó, chúng tạo điều kiện thuận lợi cho các tế bào khối u thoát ra khỏi khối u nguyên phát qua các mô xung quanh vào lòng mạch máu lân cận [22]. Bên cạnh mức độ tăng cao của ma trận metalloproteinase (tái tạo ma trận ngoại bào khối u), các tế bào khối u và nguyên bào sợi được kích hoạt tiết ra yếu tố tăng trưởng nội mô mạch máu (VEGF) và CXCL-familychemokines (ví dụ: CXCL12 và CCL2), dẫn đến việc tuyển dụng bạch cầu và tế bào nội mô vào vi môi trường khối u [3]. Các tế bào mạch máu được tuyển dụng tạo thành một hệ mạch máu khối u bất thường được đặc trưng bởi sự gia tăng tính thấm và biểu hiện của các phân tử kết dính tế bào (CAM), thúc đẩy sự xâm nhập của các tế bào khối u. Sau khi đi vào tuần hoàn toàn thân, các tế bào khối u phải đối mặt với thách thức tồn tại trong môi trường mới, xa lạ và thù địch của giường mạch. Chúng tự bảo vệ mình bằng cách ức chế quá trình sinh lý của quá trình chết tế bào được lập trình, mà các tế bào ung thư phải trải qua nếu chúng mất tương tác tế bào-ma trận hoặc tế bào-tế bào [25]. Sự ức chế này xảy ra bằng cách biểu hiện quá mức thụ thể tropomyosin kinase B (TrkB) trên màng tế bào khối u, dẫn đến kích hoạt phosphatidylinositol-4,5-bisphosphate 3kinase (PI3K) – AKT con đường hỗ trợ sinh tồn [26]. Một cơ chế khác ngăn chặn sự phá hủy các tế bào khối u bởi các đại thực bào liên quan đến việc điều chỉnh sự biểu hiện của một số protein bề mặt tế bào, chẳng hạn như cụm biệt hóa (CD) 47. Các cơ chế chịu trách nhiệm "chuyển nhà" các tế bào khối u tuần hoàn đến xương rất phức tạp và chưa được hiểu đầy đủ. Một phần quan trọng của hiện tượng này được đóng bởi hệ thống thụ thể CXCL12–CXC–chemokine 4. CXCL12, còn được gọi là yếu tố có nguồn gốc từ mô đệm –1 (SDF-1), là một yếu tố chemokine kích hoạt một số con đường tín hiệu nội bào khác nhau liên quan đến nhiều quá trình tế bào khác nhau (sự sống sót của tế bào, phiên mã gen, hóa học và biểu hiện tích hợp, chẳng hạn như integrin αVβ3 trên bề mặt của các tế bào khối u tuần hoàn). Người ta đã chỉ ra rằng sự gia tăng biểu hiện của αVβ3 trên bề mặt của các tế bào khối u tuyến tiền liệt di căn thúc đẩy sự bám dính của các tế bào khối u vào các tế bào nội mô trong tủy xương. Mặc dù cơ chế chính xác không rõ ràng, nhưng có vẻ như khi đến xương, một số tế bào ung thư bước vào trạng thái ngủ đông, dường như có thể kéo dài trong nhiều tháng nếu không muốn nói là nhiều năm. Sau khi lắng đọng trong xương, các tế bào khối u phân chia và khối u đang phát triển gây tổn thương xương tiến triển.
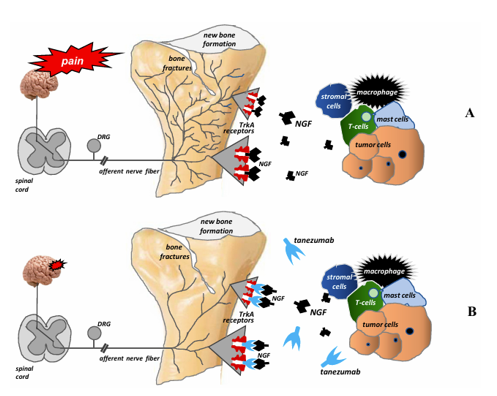
Các tế bào khối u, tế bào mô đệm và tế bào viêm được tuyển dụng bởi các tế bào khối u (đại thực bào, bạch cầu trung tính, tế bào T, tế bào mast) sản xuất và giải phóng một số chất trung gian, và nguyên bào xương, tế bào hủy xương và sợi thần kinh cung cấp cho xương đóng vai trò là tác nhân. Các chất trung gian này bao gồm endothelin, bradykinin, protease, interleukin (IL) 6, ion hydro (H +), các yếu tố kích thích khuẩn lạc (CSF), yếu tố tăng trưởng thần kinh (NGF), prostaglandin (PG)E2, serotonin và yếu tố hoại tử khối u (TNF) α. Chúng có thể làm nhạy cảm hoặc kích hoạt các đầu dây thần kinh cảm giác trong xương. Thông tin về quá trình bệnh lý và tổn thương dẫn đến được truyền đến tủy sống và sau đó đến não, nơi nhận thức diễn ra. Xương trưởng thành nhận được sự bảo quản hạn chế và duy nhất. Tất cả các khoang xương (tủy, xương khoáng hóa và màng xương bên trên) được bao bọc bởi các sợi thần kinh cảm giác, khác nhau đáng kể về mật độ của chúng. Màng xương là nơi có mật độ dày đặc nhất, trong khi ít sợi thần kinh nhất nằm trong xương khoáng hóa. Cứ 100 sợi thần kinh trong màng xương, 2 dây thần kinh có thể được tìm thấy trong tủy xương và 0,1 trong xương khoáng hóa. Các dây thần kinh cảm giác chi phối xương chủ yếu là các sợi thần kinh có bao mielin mỏng và không có bao mielin: sợi thần kinh cảm giác A-(delta) hoặc C (80% dương tính với tropomyosin kinase A (TrkA)) [14]. Có nhiều loại thụ thể và kênh ion trên các dây thần kinh cảm giác cung cấp cho xương, và chúng giúp các thụ thể đau nhận biết và truyền tín hiệu từ các kích thích có hại do tế bào ung thư và các tế bào miễn dịch liên quan đến khối u tạo ra. Thụ thể endothelin (ETAR), thụ thể prostaglandin (PG), thụ thể TrkA, thụ thể bradykinin, thụ thể cytokine, thụ thể chemokine, TRPV1 (kênh tiềm năng thụ thể nhất thời, thành viên của họ vanilloid1), kênh ion cảm nhận acid 3 (ASIC3) và thụ thể purinergic (P2X3) được kích hoạt bởi các tế bào khối u, tế bào mô đệm và các chất trung gian tế bào miễn dịch được kích hoạt, bao gồm endothelin (ET), PGE2, NGF, bradykinin và cytokine tiền viêm(TNF, interleukin (IL1, IL6, IL8, IL15), chemokine (CCL5, protein thu hút bạch cầu đơn nhân-1 (MCP-1), protein viêm đại thực bào-1a (MIP-1a)), H+, và adenosine triphosphate ngoại bào (ATP).
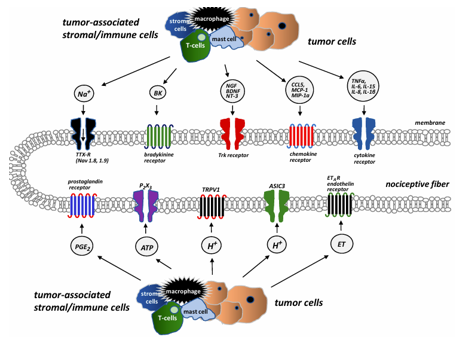
Hình 2. Các thụ thể và kênh ion trên dây thần kinh cảm giác xương.
Quá trình di căn xương phụ thuộc rất nhiều vào sự giao tiếp giữa các tế bào khối u tấn công xương, tế bào ma trận xương và các sợi thần kinh nội xương. Tế bào khối u không làm tổn thương trực tiếp mô xương; thay vào đó, chúng chủ yếu kích hoạt hệ thống RANKL/ RANK (chất kích hoạt thụ thể cho yếu tố hạt nhân) bằng cách tạo ra chất kích hoạt thụ thể cho RANKL, sau khi liên kết với RANK trên bề mặt của tế bào hủy xương, bắt đầu tăng sinh của chúng và do đó, kích hoạt tác hại của chúng đối với xương [1]. RANKL là một thành viên protein của họ cytokine của các yếu tố hoại tử khối u được sản xuất bởi các tế bào khối u, dòng tế bào nguyên bào xương (tức là bởi các nguyên bào xương trưởng thành và tiền chất của chúng) và các tế bào T được kích hoạt. Biểu hiện RANKL phụ thuộc vào một loạt các yếu tố, bao gồm cytokine (IL1, IL6, IL11, TNFα) và glucocorticosteroid. Sự liên kết của RANKL với RANK có thể đóng một vai trò quan trọng trong sự tăng sinh, biệt hóa và trưởng thành của tế bào hủy xương, hấp thụ xương bằng cách tạo thành 'vịnh' hoặc 'hố' tái hấp thu có tính axit cao giữa tế bào hủy xương và xương. Nhiễm toan do tái hấp thu kích thích các kênh TRPV1 hoặc ASIC3 và gây đau xương do ung thư (CIBP)[36]. Việc phát hiện ra cơ chế này có ý nghĩa lâm sàng. Những năm gần đây đã chứng kiến sự ra đời của denosumab, một kháng thể globulin miễn dịch G2 đơn dòng ở người chống lại RANKL, vào thực hành lâm sàng. Do ái lực và độ đặc hiệu cao của nó, denosumab liên kết với RANKL và ngăn chặn sự kích hoạt của thụ thể RANK trên bề mặt của tế bào hủy xương và tiền chất của chúng, do đó ức chế sự hình thành, tăng sinh và tồn tại của chúng và giảm sự hấp thu xương nguyên bào xương. Nhiều nghiên cứu được thực hiện trong những năm gần đây đã hỗ trợ hiệu quả của denosumab trong việc giảm đau do di căn xương, giảm tỷ lệ gãy xương bệnh lý và cải thiện chất lượng cuộc sống (QoL) và hoạt động hàng ngày của bệnh nhân di căn xương.Nhiễm toan cục bộ đóng một vai trò quan trọng trong phá hủy xương do khối u gây ra và CIBP. Nó được kích hoạt chủ yếu bởi các tế bào hủy xương (làm tan các khoáng chất xây dựng xương và làm hỏng ma trận hữu cơ) và các tế bào khối u. Tế bào hủy xương hấp thụ xương thông qua các 'vịnh' có tính axit cao giữa tế bào hủy xương và xương. Những'vịnh' này giải phóng các proton, kích thích các kênh nhạy cảm với axit, chẳng hạn như TRPV1 và ASIC, được biểu hiện bởi các tế bào thần kinh cảm giác trong xương. Các tế bào khối u trải qua cơ chế Warburg, bảo vệ chúng khỏi nhiễm toan nội bào, giải phóng H+ và lactate ra bên ngoài tế bào. H + từ các nguồn được mô tả ở trên kích thích các tế bào thần kinh cảm giác trong xương bằng cách kích hoạt các kênh nhạy cảm với axit, chủ yếu là TRPV1 và ASIC3. Thông tin về sự kích hoạt của chúng sau đó được truyền đến các tầng trên của hệ thần kinh thông qua tủy sống đến não, nơi cảm nhận được cơn đau.
Sự xâm lấn của xương bởi các tế bào khối u bắt đầu sự phát triển bệnh lý và hình thành một mạng lưới các sợi thần kinh mới với hình thái, tổ chức và mật độ độc đáo, vượt quá mật độ của các sợi thần kinh trong xương bình thường lên đến 10–70 lần. Những sợi thần kinh bệnh lý mới này được hình thành trong màng xương, mô xương khoáng hóa và tủy xương do hoạt động của các chất trung gian được sản xuất và giải phóng bởi các tế bào khối u. Người ta đã chỉ ra rằng NGF đóng một vai trò quan trọng trong việc tạo ra các mạng lưới bệnh lý như vậy. NGF thuộc họ neurotrophin. Nó được tổng hợp trong các mô xung quanh dây thần kinh và đảm bảo sự phát triển thần kinh thích hợp. Trong sức khỏe, các tế bào tổng hợp NGF bao gồm bạch cầu ái toan, tế bào mast, đại thực bào, tế bào sừng và tế bào Schwann. Trong điều kiện bệnh lý, NGF được sản xuất bởi các tế bào khối u, viêm và hệ thống miễn dịch. NGF ảnh hưởng đến các tế bào đích của nó bằng cách liên kết với hai loại thụ thể màng: TrkA (đặc hiệu cho NGF) và p75NTR (một thụ thể phổ biến cho tất cả các chất dinh dưỡng thần kinh). Khi liên kết với TrkAreceptor, NGF điều chỉnh sự giải phóng các chất dẫn truyền thần kinh (ví dụ: chất P, peptide liên quan đến gen calcitonin(CGRP)), kích hoạt các kênh ion (TRPV1, ASIC–3, P2X3, kênh natri) và thụ thể(ví dụ: đối với bradykinin), và điều chỉnh sự tổng hợp các hạt cấu trúc (ví dụ: sợi thần kinh). NGF cũng chịu trách nhiệm cho sự nảy mầm bệnh lý và tổ chức lại các sợi thần kinh cảm giác và giao cảm, cũng như sự hình thành các cấu trúc giống như u thần kinh bên trong chúng. Cơ chế thứ hai rất có thể là nguyên nhân gây ra cơn đau kịch phát và đợt cấp của nó khi vận động hoặc hoạt động ở bệnh nhân di căn xương. Sự nảy mầm này dường như cần NGF vì việc sử dụng thuốc kháng NGF hoặc chất ức chế pan-Trk kéo dài phần lớn ngăn chặn sự nảy mầm bệnh lý của các sợi thần kinh cảm giác và sự hình thành các cấu trúc giống như u thần kinh và ức chế đáng kể sự đau đớn.Trong xương bình thường, các sợi thần kinh cảm giác và giao cảm tách biệt với nhau. Sự phát triển bệnh lý do khối u gây ra của các sợi thần kinh cảm giác và giao cảm được quan sát thấy trong di căn xương dẫn đến việc tổ chức lại chúng và hình thành các kết nối giữa các loại sợi thần kinh này; Kết quả là, các kích thích đau cũng có thể được gây ra bởi sự kích hoạt của các sợi giao cảm [39]. Việc phát hiện ra các cơ chế này đã cho phép các nhà nghiên cứu tìm kiếm các phương pháp điều trị đau xương mới ở bệnh nhân ung thư. Tanezumab là một kháng thể kháng NGF đơn dòng được nhân hóa ngăn NGF kích hoạt các thụ thể TrkA. Do đó, nó ức chế sự nảy mầm bệnh lý Việc phát hiện ra những cơ chế này đã cho phép các nhà nghiên cứu tìm kiếm các phương pháp điều trị đau xương mới ở bệnh nhân ung thư. Tanezumab là một kháng thể kháng NGF đơn dòng được nhân hóa ngăn chặn NGF kích hoạt các thụ thể TrkA. Do đó, nó ức chế sự nảy mầm bệnh lý và hình thành các mạng lưới sợi thần kinh bệnh lý mới và do đó có thể làm giảm đau bệnh nhân nội trú bị đau xương di căn.
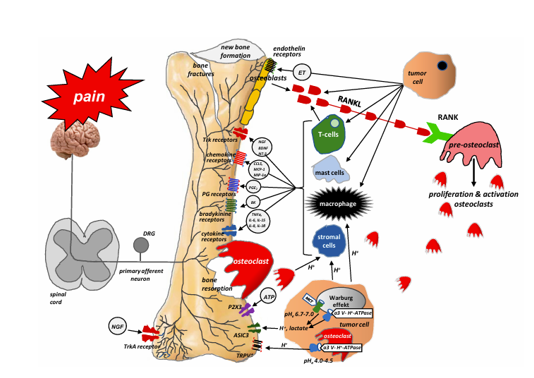
Hình 3. Tương tác giữa các tế bào khối u, nguyên bào xương, tế bào hủy xương, tế bào mô đệm và tế bào viêm tại vị trí di căn xương
III. ĐẶC ĐIỂM LÂM SÀNG CỦA ĐAU XƯƠNG Ở BỆNH NHÂN UNG THƯ DI CĂN.
Ở khoảng 20% bệnh nhân,ung thư ban đầu phát triển mà không có triệu chứng, và đau hoặc gãy xương vô lý là triệu chứng đầu tiên của bệnh [13]. Đôi khi, cơn đau xảy ra trước khi bắt đầu những thay đổi có thể phát hiện trên phim X quang ở xương. Thông thường, cơn đau xảy ra một cách tự phát, và nó khác nhau về mức độ nghiêm trọng và đặc điểm tùy thuộc vào giai đoạn bệnh. Hầu hết bệnh nhân ban đầu đều bị đau âm ỉ ngắt quãng, nhưng khi bệnh tiến triển, cơn đau trở nên liên tục và dữ dội hơn. Cường độ của nó không thể được dự đoán bằng bệnh lý ung thư, kích thước khối u, số lượng di căn, sự liên quan đến xương. Đau xương tăng lên trong quá trình vận động và có thể kèm theo sốt. Thông thường, cơn đau cũng tăng mức độ nghiêm trọng vào ban đêm. Đau khi sờ nắn thường được tìm thấy ở khu vực tổn thương xương di căn.Sự phát triển liên tục của khối u trong xương thường dẫn đến một loại đau ung thư khác: đau cấp (từng đợt). Đau cấp (từng đợt) được định nghĩa là các đợt tái phát của cơn đau dữ dội phá vỡ phác đồ được sử dụng để điều trị đau nền. Biểu hiện lâm sàng của nó bao gồm sự gia tăng cơn đau tạm thời của bệnh nhân bị đau nền ổn định và được điều trị hiệu quả [5]. Nó thường cấp tính, xuyên thấu và rất nghiêm trọng. Cơn đau cấp(từng đợt) có thể tự phát — nó có thể xảy ra mà không có tác nhân gây ra rõ ràng — hoặc ngẫu nhiên, gây ra bởi nhiều yếu tố khác nhau(thường là do cử động và chịu trọng lượng cơ thể). Trong thực hành lâm sàng hàng ngày, quan sát bệnh nhân di căn xương cho thấy đau cấp(từng đợt) thường gây ra vấn đề điều trị lớn hơn đau nền. Điều này không chỉ do lý do dịch tễ học- người ta ước tính rằng cơn đau cấp (từng đợt) xảy ra ở khoảng 75% bệnh nhân bị di căn xương - mà còn bởi khía cạnh thời gian của loại đau này (ở hơn một nửa số bệnh nhân, thời gian để có cường độ đau tối đa rất ngắn - dưới 5 phút - và cơn đau kéo dài dưới 15 phút), cũng như tính không thể đoán trước, cường độ nghiêm trọng và tác động tiêu cực đến chức năng hàng ngày và chất lượng cuộc sống (QoL). Những yếu tố này đóng một vai trò quan trọng trong việc lựa chọn các loại thuốc để điều trị cơn đau cấp (từng đợt). Ở giai đoạn sau, khi xương bị phá hủy trên diện rộng, gãy xương bệnh lý kèm theo chèn ép đồng thời và tổn thương các cấu trúc hệ thần kinh (tủy sống, rễ thần kinh, đám rối hoặc dây thần kinh ngoại biên) có thể xảy ra. Cơ chế thứ hai là một trong những nguyên nhân gây ra thành phần bệnh thần kinh của đau xương ở bệnh nhân ung thư.
IV. CÁC PHƯƠNG PHÁP CHẨN ĐOÁN TỔN THƯƠNG DI CĂN XƯƠNG.
Chụp X-quang thông thường vẫn là phương pháp hình ảnh ban đầu ở hầu hết bệnh nhân có các triệu chứng cơ xương khớp giới hạn ở một vùng cụ thể. Chúng có thể được sử dụng để đánh giá sự hiện diện của bệnh, lập kế hoạch điều trị, và đánh giá nguy cơ biến chứng xương như khả năng gãy xương. Đối với trường hợp sau, các hệ thống phân loại như điểm số Mirels để đánh giá nguy cơ gãy xương đùi gần và điểm mất vững do khối u có thể được sử dụng. Tuy nhiên, chụp X-quang thông thường không nhạy trong việc phát hiện giai đoạn đầu của sự xâm nhập tủy xương ác tính. Ít nhất 50% bè xương bị phá hủy trước khi các khối u có thể phát hiện trên X-quang. Các tổn thương nhỏ, không rõ ràng dễ bị bỏ sót trên X-quang, đặc biệt ở những bệnh nhân có mật độ xương thấp (ví dụ, khi loãng xương nền kết hợp với xâm lấn tủy lan tỏa), hoặc nếu có nhiều bóng chồng lấn phía trên. Việc phát hiện tổn thương trong khung xương trục cũng bị hạn chế bởi X-quang thông thường so với hình ảnh cắt lớp. Ở một số lượng đáng kể bệnh nhân, hình ảnh bổ sung được sử dụng để phát hiện và mô tả tổn thương.
Xạ hình xương cho thấy hiệu quả hạn chế trong đánh giá sự hiện diện cũng như gánh nặng bệnh di căn xương. Độ nhạy của phương pháp này phụ thuộc chủ yếu vào mức độ hoạt hóa tạo xương (osteoblastic activity) xung quanh các ổ thâm nhiễm tủy xương. Do đó, các khối u có hoạt tính tạo xương thấp nhưng ưu thế tiêu xương cao thường bị phát hiện kém trên xạ hình xương. Những bẫy chẩn đoán điển hình bao gồm các tổn thương tiêu xương thuần túy như trong ung thư tuyến giáp, ung thư thận, một số ung thư phổi, cũng như đa u tủy xương và các tổn thương dạng nhầy, vốn có thể hoàn toàn không thấy trên xạ hình xương phẳng. Ngoài ra, xạ hình xương có thể phát hiện các tổn thương không liên quan đến tình trạng lâm sàng của bệnh nhân, chẳng hạn như các thay đổi thoái hóa. Một số u xương lành tính, bao gồm osteoid osteoma và chondroblastoma, cũng có thể tăng bắt xạ, dẫn đến dương tính giả. Những tổn thương dương tính giả này không chỉ gây lo lắng không cần thiết cho bệnh nhân mà còn làm phức tạp quá trình chẩn đoán, đòi hỏi thêm các thăm dò hình ảnh và/hoặc sinh thiết để làm rõ. Bên cạnh đó, độ phân giải không gian hạn chế là một nhược điểm cố hữu của xạ hình xương.
Một phân tích gộp năm 2014 cho thấy, trong ung thư tuyến tiền liệt, xạ hình xương có độ nhạy và độ đặc hiệu lần lượt là 79% (KTC 95%: 73–83%) và 82% (KTC 95%: 78–85%) khi phân tích theo bệnh nhân, nhưng chỉ đạt 59% (KTC 95%: 55–63%) và 75% (KTC 95%: 71–79%) khi phân tích theo từng tổn thương. Khi kết hợp với kỹ thuật SPECT, số lượng tổn thương không xác định có thể được giảm đáng kể so với xạ hình xương phẳng thông thường.
Chụp CT có thể hữu ích trong việc làm rõ bản chất của các tổn thương được phát hiện trên xạ hình xương. Hình ảnh cắt lớp, bao gồm CT, cần thiết để đánh giá sự liên quan đến cơ quan cũng như sự lan rộng vào mô mềm của các khối u xương, điều này có thể rất quan trọng nếu chúng ảnh hưởng đến ống sống. Ở nhiều cơ sở y tế, khảo sát xương cho bệnh đa u tủy đã được thay thế bằng CT toàn thân liều thấp, 4 đến 7 mSv, thay vì CT truyền thống của cổ, ngực, bụng và khung chậu, vốn mang liều bức xạ 20mSv mỗi lần chụp. Hiệu quả chẩn đoán của CT trong việc phát hiện di căn xương đạt trung bình 73% độ nhạy và 95% độ đặc hiệu trong ung thư tuyến tiền liệt. Khi xem xét các con số này, cũng giống như với xạ hình xương, nhiều nghiên cứu được thực hiện mà không dựa trên tiêu chuẩn vàng là mô học và ở những bệnh nhân có tình trạng bệnh tiến triển hơn, điều này có thể làm lệch kết quả về hiệu quả chẩn đoán cao hơn. Mặc dù xạ hình xương và CT hiệu quả kém hơn so với các phương pháp hình ảnh thế hệ mới, nhưng điều quan trọng là phải thừa nhận rằng các hướng dẫn lâm sàng khuyến nghị kỹ thuật truyền thống như là phương pháp hình ảnh ban đầu. Việc phát hiện di căn trên CT hoặc xạ hình xương đã được chứng minh là quan trọng về tiên lượng, và gánh nặng cũng như sự phân bố của bệnh (bao gồm cả di căn xương) ảnh hưởng đáng kể đến quản lý bệnh nhân. Ví dụ, ở nam giới mắc ung thư tuyến tiền liệt nguy cơ cao, tiến triển tại chỗ, nhưng có gánh nặng di căn thấp, việc xạ trị khối u nguyên phát mang lại lợi ích sống còn rõ rệt.Trong bối cảnh này, bệnh di căn thể tích cao được định nghĩa là có từ bốn ổ di căn xương trở lên, trong đó ít nhất một ổ nằm ngoài thân đốt sống hoặc khung chậu trên xạ hình xương, hoặc có di căn tạng được phát hiện trên CT hoặc xạ hình xương. Ngược lại, những bệnh nhân không đạt tiêu chí này được xếp vào nhóm di căn thể tích thấp và là đối tượng có thể hưởng lợi từ điều trị tại chỗ khối u nguyên phát.
Các kỹ thuật hình ảnh lai như positron emission tomography (PET) và CT (PET/CT) kết hợp với nhiều loại chất đánh dấu phóng xạ được sử dụng thường xuyên để giai đoạn hóa nhiều loại khối u ác tính. Độ đặc hiệu của PET phụ thuộc vào chất đánh dấu được sử dụng, chẳng hạn như fluorodeoxyglucose (18FDG) để phát hiện sự hấp thu glucose của khối u, fluorine-18-labeled sodium fluoride (18F NaF) phát hiện hoạt động tạo xương (do đó có tên là “super bone scan”), 11C-acetate nhắm vào việc tăng lên của enzym tổng hợp axit béo trong ung thư tuyến tiền liệt, hoặc kháng nguyên màng đặc hiệu tuyến tiền liệt (PSMA) là một thụ thể xuyên màng được biểu hiện quá mức trên các tế bào ung thư tuyến tiền liệt, đặc biệt là những loại có đặc điểm mô học hung hãn hơn. Khả năng kết hợp PET để phát hiện hoạt động tế bào cụ thể với hình ảnh cắt lớp bằng CT hoặc MRI cho phép định vị và đặc tính học học của các tổn thương theo không gian 3 chiều, cũng như đánh giá bất kỳ sự phá hủy xương nào và/hoặc phản ứng màng xương. Việc đo giá trị hấp thu chuẩn hóa (SUV) biểu thị lượng chất đánh dấu được hấp thu có thể được liên kết với hoạt động bệnh, từ đó cung cấp các đánh giá bán định lượng. Hạn chế của PET/CT bao gồm khả năng sẵn có hạn chế, chi phí và gánh nặng phóng xạ. Các hạn chế bổ sung liên quan đến chất đánh dấu được sử dụng. Chẳng hạn, 18FDG-PET/CT có thể không phát hiện được một số loại khối u (ung thư thận, ung thư tuyến tiền liệt, ung thư vú dạng tiểu thùy).
WB-MRI phù hợp để triển khai rộng rãi trong các cơ sở phát hiện bệnh, với hiệu suất xét nghiệm, khả năng phổ biến rộng rãi và khả năng đánh giá đa cơ quan. Dữ liệu đầy đủ hiện nay chỉ ra rằng WB-MRI có độ chính xác cao hơn trong việc phát hiện di căn xương so với xạ hình xương để tự tin đề xuất sử dụng nó để phát hiện di căn xương.Khi so sánh với PET/CT, WB-MRI thực hiện nhanh hơn với chi phí tương đương, mà không cần các biện pháp phòng ngừa sau chụp hoặc các tác dụng phụ tiềm ẩn liên quan đến tổn thương DNA do bức xạ gây ra. Ngoài ra, WB-MRI cung cấp phương thức mạnh mẽ hơn và gần như phù hợp với tất cả khi so sánh với hình ảnh PET phụ thuộc vào chất đánh dấu, do đó cung cấp công cụ phát hiện có giá trị ở nhiều bệnh nhân. Một ưu điểm chính của WB-MRI là tính khả dụng tại địa phương, loại bỏ nhu cầu đến các trung tâm chuyên khoa, với thời gian thăm khám ngắn hơn đến các cơ sở chẩn đoán hình ảnh ngoại trú. Việc phát hiện bệnh mạnh mẽ, với khả năng tăng hiệu quả của con đường, gần đây đã được chứng minh cho những bệnh nhân nghi ngờ có thể kiểm tra đại tràng và phổi.Điều này đã dẫn đến các khuyến nghị về việc sử dụng WB-MRI trong các hướng dẫn quốc tế đối với các khối u đặc hiệu (ví dụ: u tủy và hội chứng Li-Fraumeni, và u xơ thần kinh).
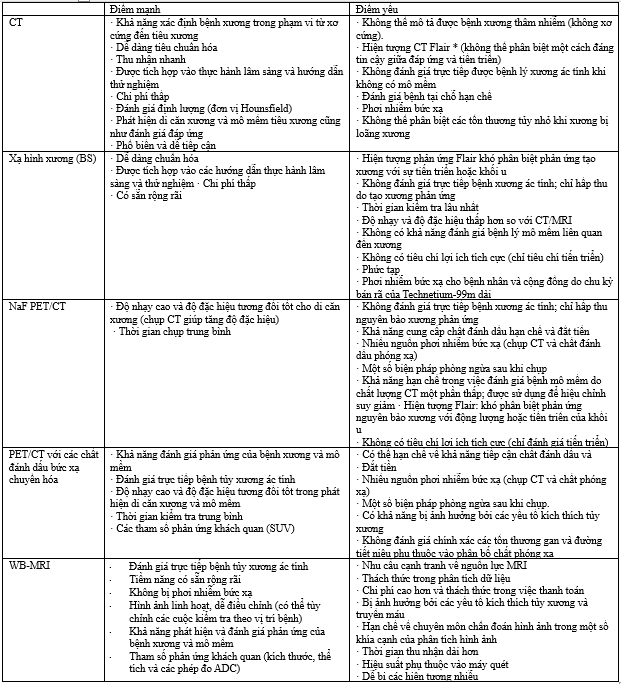
*Hiện tượng Flare thường xuất hiện vài tuần đến vài tháng sau khi bắt đầu điều trị, hay gặp trong ung thư tuyến tiền liệt và ung thư vú. Trên lâm sàng, Flare có thể đi kèm cải thiện triệu chứng và giảm marker sinh học, trái ngược với tiến triển thật sự. Việc đánh giá đơn độc dựa trên CT trong giai đoạn này có nguy cơ dẫn đến phân loại sai đáp ứng điều trị.
Sinh thiết xương làm giải phẫu bệnh là tiêu chuẩn vàng để chẩn đoán ung thư di căn xương. Sinh thiết có thể được thực hiện dưới CT.
Xét nghiệm máu: tăng Calci máu gặp trong khoảng 5-10% các trường hợp di căn xương. Tăng phosphatase kiềm máu gặp trong một số trường hợp.
V. CÁC PHƯƠNG PHÁP ĐIỀU TRỊ GIẢM ĐAU TRONG DI CĂN XƯƠNG.
5.1. Xạ trị
Theo khuyến nghị của WHO, xạ trị (RT) được sử dụng để giảm nhu cầu sử dụng thuốc giảm đau, cải thiện chất lượng cuộc sống (QoL), cũng như duy trì hoặc cải thiện chức năng xương bằng cách giảm nguy cơ. Theo khuyến nghị của WHO, xạ trị (RT) được sử dụng để giảm việc sử dụng thuốc giảm đau xương bệnh lý hoặc chèn ép tủy sống do di căn(mSCC). Có một khuyến nghị mạnh dựa trên bằng chứng chất lượng cao rằng nên sử dụng xạ trị liều đơn, liều nhỏ phân mảnh ở người lớn bị đau liên quan đến di căn xương nếu được chỉ định và có sẵn. Tất cả bệnh nhân có di căn xương nên được xem xét xạ trị ngoài hay xạ trị bằng đồng vị phóng xạ.
Đối với đau khu trú, xạ trị ngoài (external beam radiotherapy – EBRT) thường được sử dụng với nhiều phác đồ phân liều khác nhau. Về hiệu quả giảm đau, cũng như thời điểm khởi phát và thời gian duy trì đáp ứng giảm đau, phác đồ một phân liều duy nhất 8 Gy (ít phân liều) cho thấy hiệu quả tương đương với các phác đồ kéo dài hơn, như 5 phân liều 4 Gy (tổng liều 20 Gy) hoặc 10 phân liều 3 Gy (tổng liều 30 Gy). Theo các dữ liệu lâm sàng, ở cả hai nhóm phác đồ, khoảng 25% bệnh nhân đạt được giảm đau hoàn toàn và khoảng 70% đạt được giảm đau hoàn toàn hoặc một phần. Thông thường, bệnh nhân bắt đầu cảm nhận được hiệu quả giảm đau trong vòng 1–2 tuần sau điều trị.
Dựa trên các bằng chứng này, các hội đồng chuyên gia đã khuyến cáo xạ trị lại với liều 8 Gy cho những bệnh nhân có đau xương tái phát. Xạ trị ít phân liều cũng được xem là phương pháp có hiệu quả chi phí tốt cho cả người bệnh và cơ sở điều trị, ngay cả khi cần xạ trị lại. Tuy nhiên, xạ trị ít phân liều có liên quan đến nguy cơ gãy xương bệnh lý cao hơn tại vị trí được xạ trị (nguy cơ tương đối = 1,48; khoảng tin cậy 95%: 1,08–2,03), yếu tố này cần được cân nhắc cẩn trọng trong quá trình ra quyết định lâm sàng.
EBRT có thể không hiệu quả đối với bệnh nhân bị đau lan tỏa khó định vị [48]. Việc sử dụng toàn thân các dược chất phóng xạ (ví dụ: Strontium-89, Samarium-153, Rhenium, Radium-223) có thể được xem xét cho bệnh nhân bị đau xương lan tỏa do di căn xương tạo xương hoặc hỗn hợp tạo xương–hủy xương, vốn không thể điều trị hiệu quả bằng EBRT. Giảm đau thường bắt đầu từ 1–4 tuần sau khi bắt đầu điều trị. Hầu hết các nghiên cứu được tiến hành trên nam giới được chẩn đoán ung thư tuyến tiền liệt và đã cho thấy một số tác động trong việc giảm đau. Cần theo dõi cẩn thận độc tính tủy xương, chức năng thận, giảm bạch cầu và giảm tiểu cầu. Xạ trị với radium-223 có thể được khuyến nghị cho bệnh nhân ung thư tuyến tiền liệt kháng liệu pháp cắt tinh hoàn vì nó giảm các biến cố liên quan đến xương (SREs), giảm đau và cải thiện chất lượng cuộc sống cũng như tuổi thọ. Tuy nhiên, các hướng dẫn hiện tại của WHO không đưa ra khuyến nghị về việc có nên hay không nên sử dụng các đồng vị phóng xạ, chủ yếu vì chi phí và vì bằng chứng chỉ xuất phát từ các nghiên cứu về ung thư tuyến tiền liệt.
5.2. Các phương pháp can thiệp
Theo hướng dẫn của ESMO, phẫu thuật nên được cân nhắc ở bệnh nhân chèn ép tủy sống do di căn (metastatic spinal cord compression – mSCC), đặc biệt trong các trường hợp có mất vững cột sống, chưa xác định được mô bệnh học u nguyên phát, tái phát sau xạ trị trước đó hoặc chỉ có một vị trí chèn ép đơn độc. Hiện nay, phương pháp phẫu thuật tối ưu trong điều trị di căn cột sống vẫn chưa được xác định rõ ràng; tuy nhiên, cố định cột sống theo đường sau – bên kết hợp ghép xương tự thân được xem là lựa chọn ưu tiên.
Tạo hình thân đốt sống bằng bơm xi măng (vertebroplasty) hoặc tạo hình thân đốt sống có bóng (kyphoplasty)nên được xem xét ở những bệnh nhân có di căn đốt sống nhưng không có bằng chứng chèn ép tủy sống hoặc mất vững cột sống, cũng như ở các bệnh nhân có đau cơ học kháng với điều trị giảm đau hoặc xẹp thân đốt sống.
Các thủ thuật xâm lấn tối thiểu, như kyphoplasty bằng bóng hoặc vertebroplasty qua da, có thể mang lại lợi ích ở bệnh nhân di căn đốt sống không kèm theo thiếu hụt thần kinh nhưng vẫn còn đau dai dẳng. Kyriakou và cộng sự đã báo cáo kết quả tích cực trong điều trị các trường hợp gãy xẹp đốt sống do ung thư di căn và đa u tủy xương. Tăng cường thân đốt sống bằng xi măng giúp giảm đau nhanh và duy trì hiệu quả đến 1 năm, đồng thời cải thiện chức năng cột sống, nâng cao chất lượng cuộc sống, tăng mức độ hoạt động, giảm nhu cầu sử dụng thuốc giảm đau và rút ngắn thời gian nằm bất động trên giường.
Những tiến bộ gần đây bao gồm việc ứng dụng các kỹ thuật nhiệt xâm lấn tối thiểu, như đốt nhiệt bằng sóng cao tần kết hợp áp lạnh. Cụ thể, các di căn xương gây đau có thể được điều trị bằng đốt vi sóng hoặc siêu âm hội tụ cường độ cao dưới hướng dẫn của cộng hưởng từ (MR-guided HIFU).
5.3. Liệu pháp nhắm mục tiêu vào xương
5.3.1. Bisphosphonates (BPs)
Bisphosphonates Bisphosphonate (BPs) có tác dụng apoptotic trực tiếp lên tế bào hủy xương. cũng như giảm đau xương và sử dụng thuốc giảm đau, chúng ức chế biệt hóa và trưởng thành và do đó, ngăn ngừa sự hấp thu xương và tăng canxi máu, giảm tỷ lệ mắc các biến cố liên quan đến xuowg-SRE. Theo khuyến nghị của WHO, có bằng chứng mạnh mẽ từ các nghiên cứu chất lượng trung bình rằng BP nên được sử dụng để ngăn ngừa và điều trị đau xương ở người lớn (bao gồm cả người cao tuổi) [45]. BP nên được sử dụng với thuốc giảm đau ở những bệnh nhân có tiên lượng tốt, đặc biệt nếu cơn đau không khu trú hoặc RT không có sẵn [44]. Các nghiên cứu lâm sàng đã cho thấy giảm đau đáng kể và giảm nguy cơ mắc bệnh SRE khi sử dụng bisphosphonate,nhưng không có thay đổi đáng kể nào về điểm số QoL. Dữ liệu từ các nghiên cứu lâm sàng không ủng hộ lợi thế của bisphosphonate này so với bisphosphonate khác. Giảm đau và thời gian giảm đau tương tự nhau đối với từng bisphosphonate được nghiên cứu (clodronate, ibandronate, pamidronate, zoledronate). Tuy nhiên,các bác sĩ lâm sàng nên tính đến các tác dụng thận khác nhau khi kê đơn bisphosphonate. Hoại tử xương hàm là một tác dụng phụ nghiêm trọng khác. Thiếu sự đồng thuận về việc bắt đầu và thời gian điều trị tối ưu. Theo Hiệp hội Ung thư Lâm sàng Hoa Kỳ, điều trị bằng Bisphosphonate nên được bắt đầu ngay sau khi chẩn đoán di căn xương và nên tiếp tục cho đến khi tình trạng chung của bệnh nhân giảm đáng kể.
5.3.2. Kháng thể đơn dòng
Denosumab là một kháng thể tổng hợp ở người, đơn dòng,liên kết với RANKL để ngăn chặn sự tương tác của nó với RANKL (Hình 3). Sự liênkết của RANKL với RANK là cần thiết cho sự tăng sinh và trưởng thành của tế bào hủy xương do sinh lý và khối u gây ra [1,36,57]. Điều trị bằng denosumab làm giảm chức năng tế bào hủy xương và do đó trì hoãn SRE và tái phát đau xương, cải thiện chức năng QoLand của bệnh nhân di căn xương [37,38]. Theo ESMO, denosumab được chỉ định thay thế cho bisphosphonate cho bệnh nhân di căn xương từ khối u rắn và u tủy.
Cần có các biện pháp nha khoa để ngăn ngừa hoại tử xương hàm trước khi dùng denosumab. Các nghiên cứu so sánh bisphosphonate với denosumab đã gợi ý rằng denosumab làm giảm nguy cơ mắc các biến cố liên quan đến xương và cải thiện kết quả chức năng nhiều hơn bisphosphonate, nhưng nó làm tăng nguy cơ hoại tử xương hàm và không ảnh hưởng đến đau xương hoặc thời gian giảm đau
Hình 5. Vai trò của hệ thống RANKL/RANK và cơ chế tác động của denosumab trong đau xương do ung thư. RANKL là một loại protein được tiết ra bởi tế bào khối u và dòng tế bào tạo xương (tức là bởi các nguyên bào xương trưởng thành và các tế bào tiền thân của chúng). RANKL gắn vào thụ thể RANK trên bề mặt tế bào hủy xương, kích thích sự sinh sản và trưởng thành của tế bào hủy xương, từ đó khởi phát tác động phá hủy xương. Denosumab có đặc tính ái lực cao và tính đặc hiệu đối với RANKL. Nó ngăn chặn sự kích hoạt của các thụ thể RANK trên bề mặt tế bào hủy xương và các tế bào tiền thân của chúng.
Tanezumab là một kháng thể đơn dòng nhân hóa tái tổ hợp. Nó liên kết lưu thông và NGF mô cục bộ để ngăn chặn sự tương tác của nó với các thụ thể TrkA và các thụ thể p75. Sự tương tác của NGF với các thụ thể TrkA là rất quan trọng trong cảm nhận cảm giác vì nó điều chỉnh biểu hiện và chức năng của các kênh natri Nav 1.8 và TRPV1 và làm tăng tổng hợp các chất cảm nhận (chất P, CGRP) và protein kênh natri, cuối cùng có thể dẫnđến tăng đau. Trong ung thư xương, một số tế bào mô đệm liên quan đến khối u (đại thực bào, tế bào lympho T, tế bào mast, tế bào nội mô) có thể biểu hiện và giải phóng NGF. Các nghiên cứu tiền lâm sàng đã tiết lộ rằng các liệu pháp ngăn chặn NGF hoặc TrkA, khi được thực hiện sau khi hình thành u thần kinh và / hoặc u thần kinh do khối u gây ra, có thể ức chế sự nảy mầm bệnh lý và / hoặc hình thành u thần kinh. Tanezumab đã được nghiên cứu rộng rãi ở những bệnh nhân bị đau mãn tính không phải ung thư cơ xương, nhưng dữ liệu về hiệu quả của nó đối với cơn đau do ung thư vẫn thưa thớt. Chỉ có một nghiên cứu so sánh tanezumab với giả dược ở những bệnh nhân di căn xương đau. Nghiên cứu này cho thấy không có sự khác biệt về giảm đau đối với tỷ lệ phần trăm những người đã trải qua quá trình giảm đau giữa các nhóm. Do dữ liệu và bằng chứng còn hạn chế, các chuyên gia của WHO đã không thể khuyến nghị hoặc không khuyến nghị kháng thể đơn dòng để điều trị.
5.3.3. Thuốc giảm đau theo thang giảm đau của WHO.
Điều trị đau xương cần xem xét việc sử dụng thuốc giảm đau ở bất kỳ giai đoạn nào của bệnh. Mục đích chính của việc kiểm soát cơn đau bằng thuốc giảm đau là giảm đau nhanh chóng khi nghỉ ngơi và trong quá trình vận động, không phải để ngăn ngừa các biến cố liên quan đến xương. Trên cơ sở bằng chứng chất lượng thấp, WHO khuyến cáo rằng,đối với người lớn (bao gồm cả người lớn tuổi) và thanh thiếu niên bị đau liên quan đến ung thư, nên sử dụng thuốc giảm đau không steroid (NSAID), paracetamol và opioid - đơn lẻ hoặc kết hợp - khi bắt đầu kiểm soát cơn đau, tùy thuộc vào đánh giá lâm sàng và mức độ nghiêm trọng của cơn đau. WHO khuyến nghị phương pháp tiếp cận thang giảm đau ba bước dựa trên cường độ đau. Ở mỗi bước, nên xem xét các loại thuốc bổ trợ giải quyết các cơ chế đau cụ thể [45]. Ở những bệnh nhân có cường độ đau nhẹ (tức là điểm <4 trên thang đánh giá số (NRS)), các loại thuốc không dùng thuốc giảm đau không opioid như acetaminophen hoặc / và NSAID được khuyến cáo. NSAID ức chế tổng hợp PG thông qua cyclooxygenase (COX)và giảm phù nề tại chỗ và nhạy cảm do PG gây ra, vì vậy các bác sĩ lâm sàng coi chúng hữu ích cho đau do di căn xương vì nhiều triệu chứng liên quan đến viêm cục bộ và tổn thương mô. Ý kiến này dựa trên kinh nghiệm chứ không phải bằng chứng mạnh mẽ, và hiệu quả của NSAID trong điều trị đau do di căn xương ở người chưađược xác nhận. Tuy nhiên, trong các nghiên cứu thực nghiệm, sự ức chế tổng hợp PGE2 bởi các chất ức chế COX-2 dẫn đến giảm sự phát triển của ung thư xương hoặc giảm hành vi đau ở chuột. Trong một đánh giá hệ thống cơ sở dữ liệu Cochrane,Derry và cộng sự cho thấy rằng không có bằng chứng chất lượng cao nào để hỗ trợ hoặc bác bỏ việc sử dụng NSAID một mình hoặc kết hợp với opioid. Mặc dù chất lượng bằng chứng là thấp, đau trung bình hoặc nặng giảm xuống đau nhẹ sau 1 tuần hoặc2 tuần với NSAID lần lượt ở 26% và 51% bệnh nhân. Hạn chế chính của điều trịlâu dài bằng NSAID là nguy cơ kích ứng/chảy máu đường tiêu hóa (GI), giảm chức năng thận, biến cố tim mạch hoặc rối loạn chảy máu. Bệnh nhân cao tuổi đặc biệt dễ bị tổn thương bởi tất cả các tác dụng phụ [64]. Ở những bệnh nhân chống chỉ định với NSAID, có thể xem xét acetaminophen, nhưng nó kém hiệu quả hơn NSAID trong điều trị đau xương. Tuy nhiên, không có nghiên cứu lâm sàng nào so sánh trực tiếp cả hai chất ở bệnh nhân đau do di căn xương. Opioid "mạnh" là trụ cột của liệu pháp giảm đau trong điều trị cơn đau liên quan đến ung thưtừ trung bình đến nặng. Những loại thuốc này phát huy tác dụng lâm sàng của chúng bằng cách ảnh hưởng đến các thụ thể opioid, được phân thành ba nhóm: MOR(μ), DOR (δ) và KOR (κ). Mặc dù tồn tại nhiều loại opioid "mạnh" với các đặc tính dược lý khác nhau, nhưng chúng không vượt trội hơn loại khác trong thực hành lâm sàng về hiệu quả. Opioid có hiệu quả chống lại đau soma, thần kinh và đau hỗn hợp. Chúng có thể làm giảm đau nền và từng đợt ở bệnh nhân đau do di căn xương. Opioid được sử dụng rộng rãi ở bệnh nhân ung thư, nhưng các nghiên cứu đã gợi ý rằng một số trong số chúng có thể thúc đẩy sự tiến triển của ung thư. Các cơ chế chính chịu trách nhiệm cho tác dụng này là kích thích hìnhthành mạch và ức chế miễn dịch, chủ yếu qua trung gian bởi chủ vận ở MOR. Các nghiên cứu đã gợi ý rằng morphine có khả năng ức chế miễn dịch lớn nhất và fentanyl có tiềm năng trung bình, trong khi buprenorphine và tramadol cho thấy tác dụng ức chế miễn dịch thấp nhất hoặc không có tác dụng ức chế miễn dịch.Các nghiên cứu thực nghiệm đã chỉ ra rằng chất chủ vận KOR có hiệu quả trong điều trị chuột CIBPin, mà không làm thay đổi kích thước khối u hoặc sự tăng sinh trong các dòng tế bào ung thư. Những dữ liệu này cho thấy rằng KORagonists có thể được sử dụng để kiểm soát cơn đau do ung thư mà không có nhược điểm của chất chủ vận MOR và không làm trầm trọng thêm sự tiến triển của bệnh.
Opioid được sử dụng rộng rãi trong điều trị đau ở bệnh nhân ung thư; tuy nhiên, một số nghiên cứu cho thấy một số opioid có thể thúc đẩy sự tiến triển của ung thư. Các cơ chế chính liên quan đến hiện tượng này bao gồm kích thích quá trình tạo mạch và gây ức chế miễn dịch, chủ yếu thông qua tác dụng chủ vận lên thụ thể μ-opioid (MOR). Các nghiên cứu cho thấy morphin có tiềm năng gây ức chế miễn dịch mạnh nhất, fentanyl có mức độ trung gian, trong khi buprenorphin và tramadol thể hiện tác dụng ức chế miễn dịch thấp hoặc không đáng kể.
Các nghiên cứu thực nghiệm đã chứng minh rằng các chất chủ vận thụ thể κ-opioid (KOR) có hiệu quả trong điều trị đau xương do ung thư (cancer-induced bone pain, CIBP) trên mô hình chuột, mà không làm thay đổi kích thước khối u hoặc mức độ tăng sinh của các dòng tế bào ung thư. Những dữ liệu này gợi ý rằng các chất chủ vận KOR có thể là lựa chọn tiềm năng trong kiểm soát đau ung thư, giúp tránh được những hạn chế của các chất chủ vận MOR và không làm trầm trọng thêm tiến triển của bệnh.
5.5. Thuốc giảm đau bổ trợ
5.5.1. Corticosteroid
Corticosteroid là một trong những thuốc giảm đau bổ trợ được sử dụng phổ biến nhất để kiểm soát đau xương di căn, đau thần kinh do thâm nhiễm hoặc chèn ép cấu trúc thần kinh, cũng như đau đầu do tăng áp lực nội sọ và đau nội tạng. Corticosteroid tác dụng chống viêm và giảm phù nề mạnh. Việc giảm phù nề quanh khối u không đáp ứng với liệu pháp corticosteroid có thể dẫn đến cải thiện giảm đau. Corticosteroid cũng có thể ảnh hưởng gián tiếp đến hoạt hóa nociceptor bằng cách giảm mức độ prostanoid và pro-viêmcytokine, hoặc chúng có thể trực tiếp làm giảm hoạt động điện bệnh lý của các tế bào thần kinh ngoại vi bị tổn thương, do đó làm giảm cường độ đau [71]. Trên cơ sở bằng chứng chất lượng trung bình, WHO đặc biệt khuyến cáo rằng người lớn (bao gồm cả người lớn tuổi) và thanh thiếu niên bị đau liên quan đến ung thư nên sử dụng corticosteroid bổ trợ để kiểm soát cơn đau nếu được chỉ định. Một Đánh giá Hệ thống Cơ sở dữ liệu Cochrane được thực hiện bởi Haywood và cộng sự cho thấy bằng chứng về hiệu quả của corticosteroid trong việc kiểm soát cơn đau ở bệnh nhân ung thư là yếu (mặc dù giảm đau đáng kể đã được ghi nhận trong một số nghiên cứu). Các tác giả kết luận rằng hồ sơ tác dụng phụ của corticosteroid (đặc biệt là trong dài hạn) không được thiết lập tốt. Dữ liệu về hiệu quả của corticosteroid ở bệnh nhân đau do di căn xương còn thưa thớt, vì vậy các hướng dẫn lâm sàng khuyến cáo sử dụng corticosteroid để điều trị đau do di căn xương trên ý kiến chuyên gia hơn là bằng chứng mạnh mẽ. Nói chung, corticosteroid nên được kê đơn trong một thời gian ngắn nhất có thể và quyết định của bác sĩ lâm sàng nên được cá nhân hóa cho từng bệnh nhân. Các bác sĩ lâm sàng nên tính đến vị trí và loại đau, sự hiện diện của nguy cơ nhiễm trùng, đái tháo đường, giai đoạn bệnh và các liệu pháp đồng thời. Corticosteroid có tác dụng mineralocorticoid ít nhất được ưu tiên. Dexamethasone là corticosteroid được sử dụng phổ biến nhất vì thời gian bán hủy dài và thiếu hoạt tính của mineralocorticoid, dẫn đến giữ nước ít hơn. Liều dao động từ trung bình (8 mg/ngày) đến cực cao (36–96 mg/ngày, trước đó là bolus 10–100 mg tiêm tĩnh mạch). Corticosteroid thường giảm dần trong 2 tuần.
5.5.2. Thuốc chống co giật
Thuốc chống co giật được sử dụng rộng rãi và được khuyến cáo trong điều trị nhiều hội chứng đau thần kinh ở người. Các nghiên cứu trên động vật cũng ghi nhận hiệu quả của các chất gắn vào tiểu đơn vị α2δ trong các mô hình đau xương do ung thư (cancer-inducedbone pain, CIBP). Trong các mô hình này, tính kích thích của các đường dẫn truyền xử lý cảm giác đau tại sừng sau tủy sống tăng lên, dẫn đến hiện tượng tăng nhạy cảm đau. Gabapentin, thông qua tác động lên tiểu đơn vị α2δ của kênh calci, có khả năng làm giảm hiện tượng nhạy cảm hóa trung ương và giảm các hành vi biểu hiện đau.
Các nghiên cứu thực nghiệm cho thấy pregabalin và gabapentin có thể có giá trị lâm sàng trong điều trị bệnh nhân CIBP. Một báo cáo ca lâm sàng đánh giá việc sử dụng gabapentin ở bệnh nhân CIBP ghi nhận khả năng mang lại hiệu quả tích cực. Dữ liệu từ các nghiên cứu thực nghiệm và quan sát lâm sàng đã dẫn đến việc gia tăng sử dụng pregabalin hoặc gabapentin trong thực hành lâm sàng; tuy nhiên, bằng chứng khoa học hiện nay vẫn chưa thống nhất. Một tỷ lệ bệnh nhân cao hơn trong nhóm được điều trị bằng pregabalin báo cáo mức giảm đau đạt 30% hoặc 50% so với giả dược, tuy nhiên hiệu quả còn thấp. Ngược lại, một thử nghiệm lâm sàng ngẫu nhiên khác đánh giá pregabalin ở bệnh nhân đau xương do ung thư không ghi nhận lợi ích đáng kể về điểm số đau, mức độ ảnh hưởng của đau đến sinh hoạt hay chất lượng cuộc sống so với giả dược. Dù vậy, bệnh nhân được điều trị bằng pregabalin có cải thiện về tâm trạng và ghi nhận ít cơn đau cấp hơn.
Một cách lý giải cho sự không nhất quán giữa các thử nghiệm lâm sàng là thành phần đau thần kinh chỉ được xác định ở khoảng 17% bệnh nhân đau xương do ung thư. Việc nhận diện rõ cơ chế nền của hội chứng đau ở từng bệnh nhân, đặc biệt là thành phần đau thần kinh,có thể giúp cải thiện hiệu quả của các thuốc giảm đau thần kinh trong điều trị đau xương do ung thư và nâng cao chất lượng kiểm soát đau ở bệnh nhân ung thư.Cho đến nay, các bằng chứng từ thử nghiệm lâm sàng cho thấy pregabalin và gabapentin nhìn chung không chứng minh được hiệu quả rõ ràng trong điều trị đau xương do ung thư.
VI. KẾT LUẬN
Hệ xương là một trong ba vị trí di căn thường gặp nhất trong những bệnh lý ung thư, trong đó rất thường gặp ở các vị trí xương trục điều này không chỉ gây các biến chứng đau xương,gãy xương bệnh lý, tăng calci máu mà còn gây chèn ép tủy sống, suy giảm chức năng vận động và làm giảm chất lượng sống.Việc chẩn đoán di căn xương cần kết hợp nhiều phương pháp trong đó các phương pháp như CT, WB-MRI, PET/CT đem lại nhiều giá trị không chỉ trong xác định giai đoạn, chẩn đoán di căn sớm ở bệnh nhân ung thư. Đau trong ung thư di căn xương dai dẳng, cường độ và mức độ đau nhiều là một thách thức trong điều trị và cải thiện chất lượng sống của bệnh nhân. Hiện nay, tình trạng đau xương do di căn đã được giải thích bằng nhiều cơ chế từ đó áp dụng và kết hợp được nhiều phương pháp điều trị khác nhau mở ra nhiều lựa chọn hơn cho các bác sỹ.
VII. TÀI LIỆU THAM KHẢO
1. Lương Ngọc Khuê, Mai Trọng Khoa, và CS. Hướng dẫn chẩn đoán và điều trị một số bệnh ung bướu. Nhà xuất bản Y học; 2020.
2. Lecouvet, F.; Dalili, D.; Isaac, A.; Fayad, L.;Pasoglou, V.; Papakonstantinou, O.; Ahlawat, S.; Messiou, C.; Weber, M.-A.;Padhani, A.R. Detection and Characterization of Musculoskeletal Cancer UsingWhole-Body Magnetic Resonance Imaging. Radiol. Clin. North Am. 2023,61, 469–487.
3. Zajączkowska, R.; Kocot-Kępska, M.; Leppert, W.;Wordliczek, J. Bone Pain in Cancer Patients: Mechanisms and Current Treatment. Int.J. Mol. Sci. 2019, 20, 6047.